上海晅科生物科技有限公司
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
上海晅科生物科技有限公司
入驻年限:7 年
- 联系人:
朱经理
- 所在地区:
上海 奉贤区
- 业务范围:
试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒、技术服务、体外诊断、实验室仪器 / 设备、耗材
- 经营模式:
生产厂商 经销商 代理商 科研机构
推荐产品
公司新闻/正文
草鱼出血热病毒(GCHV)PCR试剂盒说明书
243 人阅读发布时间:2024-12-10 09:51
【产品名称】
草鱼出血热病毒(GCHV)核酸检测试剂盒(荧光 PCR 法)
商品名称:草鱼出血热病毒(GCHV)核酸检测试剂盒(荧光 PCR 法)
Name :Grass Carp Hemorrhage Virus Detection Kit(Real-Time PCR Method)
【包装规格】50T/盒
【预期用途】 本试剂盒适用于检测草鱼的鳃,脑、肝、肾、脾等器官组织标本中草鱼出血热病毒 RNA,适用于草鱼出血热病毒感染的辅助诊断。
【检验原理】 本试剂盒对草鱼出血热病毒基因设计特异性的引物和探针,用一步法荧光 RT-PCR 技术对草鱼出血热病毒 RNA 进行体外扩增检测,用于科研实验中对可疑感染者的病原学检测。
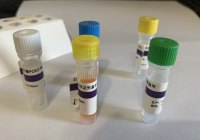
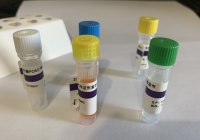
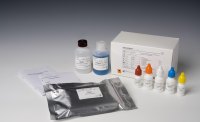
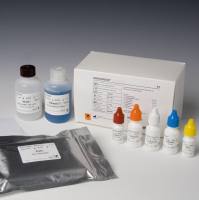
【试剂组成】 包装规格 50T/盒 GCHV 反应液 500μL×2 管 酶液 50μL×1 管 GCHV 阳性质控品 50μL ×1 管 阴性质控品 250μL ×1 管
注:
1)不同批号试剂不能混用。
2)试剂盒内各试剂组份足够包装规格所标示的检测次数。
【储存条件及有效期】 -20℃±5℃,避光保存、运输、反复冻融次数不超过 5 次,有效期 12 个月。
【适用仪器】 ABI 、安捷伦 MX3000P/3005P、LightCycler、Bio-Rad、Eppendorf 等系列荧光定量 PCR 检测仪。
【标本采集】 取草鱼的鳃,脑、肝、肾、脾等器官组织。
【保存和运输】 上述标本短期内可保存于-20℃,长期保存可置-70℃,但不能超过 6 个月,标本运送应采用 2~8℃冰袋运输,严禁反复冻融。
【使用方法】 1. 样品处理(样本处理区)
1.1 样本前处理 每份组织分别从 3 个不同的位置称取样品约 1g,手术剪剪碎混匀后取 0.5g 于研磨器中研磨,加入 1.5mL 生理盐水后继续研磨,待匀浆后转至 1.5mL 灭菌离心管中,8000rpm 离心 2min,取上清液 100μL 于 1.5mL 灭菌离心管中。
1.2 核酸提取 推荐采用上海晅科生物科技有限公司生产的核酸提取或纯化试剂(磁珠法或离心柱法)进行核酸提取,请按照试剂说明书进行操作。
2. 试剂配制(试剂准备区) 根据待检测样本总数,设所需要的 PCR 反应管管数为 N(N=样本数+1 管阴性对照+1 管阳性对照;反应管数每满 10 份,多配制 1 份),每测试反应体系配制如下表: 试剂 GCHV 反应液 酶液 用量 20μL 1μL 将混合好的测试反应液分装到 PCR 反应管中,21uL/管。
3. 加样(样本处理区) 将步骤 1 提取的核酸、阳性质控品、阴性质控品各取 4μL,分别加入相应的反应管中,盖好管盖,混匀, 短暂离心。
4. PCR 扩增(核酸扩增区)
4.1 将待检测反应管置于荧光定量 PCR 仪反应槽内;
4.2 设置好通道、样品信息,反应体系设置为 25μL;荧光通道选择: 检测通道(Reporter Dye)FAM, 淬灭通道(Quencher Dye)NONE,ABI 系列仪器请勿选择 ROX 参比荧光,选择 None 即可。
4.3 推荐循环参数设置: 步骤 循环数 温度 时间 收集荧光信号 1 1 cycle 42℃ 20min 否 2 1 cycle 95℃ 10min 否 3 40 cycles 94℃ 15sec 否 55℃ 30sec 是
5. 结果分析判定
5.1 结果分析条件设定 设置 Baseline 和 Threshold:一般直接按机器自动分析的结果分析,当曲线出现整体倾斜时,根据分析后图像调节 Baseline 的 start 值(一般可在 3~15 范围内调节)、stop 值(一般可在 5~20 范围内调节),以及Threshold 的 Value 值(上下拖动阈值线至高于阴性对照),重新分析结果。
5.2 结果判断 阳性:检测通道 Ct 值≤35,且曲线有明显的指数增长曲线; 可疑:检测通道 35<Ct 值≤38,建议重复检测,如果检测通道仍为 35<Ct 值≤38,且曲线有明显的增长曲线, 判定为阳性,否则为阴性; 阴性:样本检测结果 Ct 值>38 或无 Ct 值。
6. 质控标准 阴性质控品:Ct>38 或无 Ct 值显示; 阳性质控品:扩增曲线有明显指数生长期,且 Ct 值≤32; 以上条件应同时满足,否则实验视为无效。
7. 检测方法的局限性
7.1. 样本检测结果与样本收集、处理、运送以及保存质量有关;
7.2. 样本提取过程中没有控制好交叉污染,会出现假阳性结果;
7.3. 阳性对照、扩增产物泄漏,会导致假阳性结果;
7.4. 病原体在流行过程中基因突变、重组,会导致假阴性结果;
7.5. 不同的提取方法存在提取效率差异,会导致假阴性结果;
7.6. 试剂运输,保存不当或试剂配制不准确引起的试剂检测效能下降,出现假阴性或定量检测不准确的结果;
7.7. 本检测结果仅供参考,如须确诊请结合临床症状以及其他检测手段。
【注意事项】
1. 所有操作严格按照说明书进行;
2. 试剂盒内各种组分使用前应自然融化,完-全混匀并短暂离心;
3. 反应液应避光保存;
4. 反应中尽量避免气泡存在,管盖需盖紧;
5. 使用一次性吸头、一次性手套和各区专用工作服;
6. 样本处理、试剂配制、加样需在不同区进行,以免交叉污染;
7. 实验完毕后用 10%次氯酸或 75%酒精或紫外灯处理工作台和移液器;
8. 试剂盒里所有物品应视为污染物对待,并按照《微生物生物医学实验室生物安全通则》进行处理。
草鱼出血热病毒(GCHV)核酸检测试剂盒(荧光 PCR 法)
商品名称:草鱼出血热病毒(GCHV)核酸检测试剂盒(荧光 PCR 法)
Name :Grass Carp Hemorrhage Virus Detection Kit(Real-Time PCR Method)
【包装规格】50T/盒
【预期用途】 本试剂盒适用于检测草鱼的鳃,脑、肝、肾、脾等器官组织标本中草鱼出血热病毒 RNA,适用于草鱼出血热病毒感染的辅助诊断。
【检验原理】 本试剂盒对草鱼出血热病毒基因设计特异性的引物和探针,用一步法荧光 RT-PCR 技术对草鱼出血热病毒 RNA 进行体外扩增检测,用于科研实验中对可疑感染者的病原学检测。
【试剂组成】 包装规格 50T/盒 GCHV 反应液 500μL×2 管 酶液 50μL×1 管 GCHV 阳性质控品 50μL ×1 管 阴性质控品 250μL ×1 管
注:
1)不同批号试剂不能混用。
2)试剂盒内各试剂组份足够包装规格所标示的检测次数。
【储存条件及有效期】 -20℃±5℃,避光保存、运输、反复冻融次数不超过 5 次,有效期 12 个月。
【适用仪器】 ABI 、安捷伦 MX3000P/3005P、LightCycler、Bio-Rad、Eppendorf 等系列荧光定量 PCR 检测仪。
【标本采集】 取草鱼的鳃,脑、肝、肾、脾等器官组织。
【保存和运输】 上述标本短期内可保存于-20℃,长期保存可置-70℃,但不能超过 6 个月,标本运送应采用 2~8℃冰袋运输,严禁反复冻融。
【使用方法】 1. 样品处理(样本处理区)
1.1 样本前处理 每份组织分别从 3 个不同的位置称取样品约 1g,手术剪剪碎混匀后取 0.5g 于研磨器中研磨,加入 1.5mL 生理盐水后继续研磨,待匀浆后转至 1.5mL 灭菌离心管中,8000rpm 离心 2min,取上清液 100μL 于 1.5mL 灭菌离心管中。
1.2 核酸提取 推荐采用上海晅科生物科技有限公司生产的核酸提取或纯化试剂(磁珠法或离心柱法)进行核酸提取,请按照试剂说明书进行操作。
2. 试剂配制(试剂准备区) 根据待检测样本总数,设所需要的 PCR 反应管管数为 N(N=样本数+1 管阴性对照+1 管阳性对照;反应管数每满 10 份,多配制 1 份),每测试反应体系配制如下表: 试剂 GCHV 反应液 酶液 用量 20μL 1μL 将混合好的测试反应液分装到 PCR 反应管中,21uL/管。
3. 加样(样本处理区) 将步骤 1 提取的核酸、阳性质控品、阴性质控品各取 4μL,分别加入相应的反应管中,盖好管盖,混匀, 短暂离心。
4. PCR 扩增(核酸扩增区)
4.1 将待检测反应管置于荧光定量 PCR 仪反应槽内;
4.2 设置好通道、样品信息,反应体系设置为 25μL;荧光通道选择: 检测通道(Reporter Dye)FAM, 淬灭通道(Quencher Dye)NONE,ABI 系列仪器请勿选择 ROX 参比荧光,选择 None 即可。
4.3 推荐循环参数设置: 步骤 循环数 温度 时间 收集荧光信号 1 1 cycle 42℃ 20min 否 2 1 cycle 95℃ 10min 否 3 40 cycles 94℃ 15sec 否 55℃ 30sec 是
5. 结果分析判定
5.1 结果分析条件设定 设置 Baseline 和 Threshold:一般直接按机器自动分析的结果分析,当曲线出现整体倾斜时,根据分析后图像调节 Baseline 的 start 值(一般可在 3~15 范围内调节)、stop 值(一般可在 5~20 范围内调节),以及Threshold 的 Value 值(上下拖动阈值线至高于阴性对照),重新分析结果。
5.2 结果判断 阳性:检测通道 Ct 值≤35,且曲线有明显的指数增长曲线; 可疑:检测通道 35<Ct 值≤38,建议重复检测,如果检测通道仍为 35<Ct 值≤38,且曲线有明显的增长曲线, 判定为阳性,否则为阴性; 阴性:样本检测结果 Ct 值>38 或无 Ct 值。
6. 质控标准 阴性质控品:Ct>38 或无 Ct 值显示; 阳性质控品:扩增曲线有明显指数生长期,且 Ct 值≤32; 以上条件应同时满足,否则实验视为无效。
7. 检测方法的局限性
7.1. 样本检测结果与样本收集、处理、运送以及保存质量有关;
7.2. 样本提取过程中没有控制好交叉污染,会出现假阳性结果;
7.3. 阳性对照、扩增产物泄漏,会导致假阳性结果;
7.4. 病原体在流行过程中基因突变、重组,会导致假阴性结果;
7.5. 不同的提取方法存在提取效率差异,会导致假阴性结果;
7.6. 试剂运输,保存不当或试剂配制不准确引起的试剂检测效能下降,出现假阴性或定量检测不准确的结果;
7.7. 本检测结果仅供参考,如须确诊请结合临床症状以及其他检测手段。
【注意事项】
1. 所有操作严格按照说明书进行;
2. 试剂盒内各种组分使用前应自然融化,完-全混匀并短暂离心;
3. 反应液应避光保存;
4. 反应中尽量避免气泡存在,管盖需盖紧;
5. 使用一次性吸头、一次性手套和各区专用工作服;
6. 样本处理、试剂配制、加样需在不同区进行,以免交叉污染;
7. 实验完毕后用 10%次氯酸或 75%酒精或紫外灯处理工作台和移液器;
8. 试剂盒里所有物品应视为污染物对待,并按照《微生物生物医学实验室生物安全通则》进行处理。